
Proces korozji jest zagadnieniem trudnym do wyjaśnienia, ponieważ korozja metali obejmuje wiedzę z dziedziny chemii, termodynamiki i chemii fizycznej. Korozję można spowolnić poprzez zastosowanie opakowań z lotnymi inhibitorami korozji VCI (ang. volatile corrosion inhibitor), lub poprzez nałożenie powłok chemicznych, takich jak preparaty na bazie olejów, powłoki galwaniczne lub powłoki malarskie. Z drugiej strony, proces korozji może ulec również drastycznemu przyspieszeniu w wyniku oddziaływania innych czynników środowiskowych. W artykule chcielibyśmy przedstawić uproszczony schemat powstawania korozji, opisać jak działają lotne inhibitory VCI oraz wskazać najbardziej powszechne czynniki środowiskowe, które akcelerują proces korozji.
Proces korozji
Przyjrzymy się procesom powstawania korozji metalu, przyczynom powstawania oraz mechanizmom jakie zachodzą na powierzchni metalu.
Przyczyny korozji metali

Korozja jest zwykle spowodowana uszkodzeniem mechanicznym lub chemicznym powierzchni metalu. Najczęstsze czynniki wywołujące korozję metali to:
- Obróbka mechaniczna – w procesie obróbki usuwana jest warstwa tlenku, która stanowi naturalną ochronę metalu przed rdzą. Po obróbce powierzchnia metalu staje się bardziej podatna na korozję.
- Wilgoć – w momencie osiągnięcia odpowiedniej wilgotności względnej, na każdej powierzchni metalowej formuje się cienka warstwa wody.
- Kwasy organiczne – kwasy zawarte w materiałach organicznych, takich jak drewno, papier czy tektura, mogą powodować korozję w momencie bezpośredniego styku materiału z powierzchnią metalu
- Zanieczyszczenia – tlen atmosferyczny, chlorki i dwutlenek siarki, mogą przyczyniać się do powstawania ognisk rdzy.
- Sól – jony chlorku, przy udziale wody i tlenu wchodzą w reakcję z metalem, którego efektem ubocznym jest powstawanie kwasu solnego. Na dodatek, podczas dysocjacji NaCl powstają jony, które zwiększają przewodnictwo prądu elektrycznego w roztworze.
- Odciski palców – pozostawione na powierzchni metalu przez nieuważnych operatorów, są przyczyną powstawania ognisk rdzy.
Schemat powstawania korozji
Bardzo cienka pasywna warstwa tlenków działa jako warstwa barierowa pomiędzy powierzchnią i wilgotnym powietrzem atmosferyczny. Jest ona naturalną barierą chroniącą metal przed korozją.

Zagrożeniem dla stali może być wilgoć zawarta w powietrzu atmosferycznym.

Przy wilgotności przewyższającej 40%, na ciałach stałych wystawionych na kontakt z powietrzem powstaje cienka warstwa wody.

Powstała warstwa wilgoci, pomimo tego że jest praktycznie niezauważalna, może powodować zniszczenie pierwotnej warstwy tlenków.
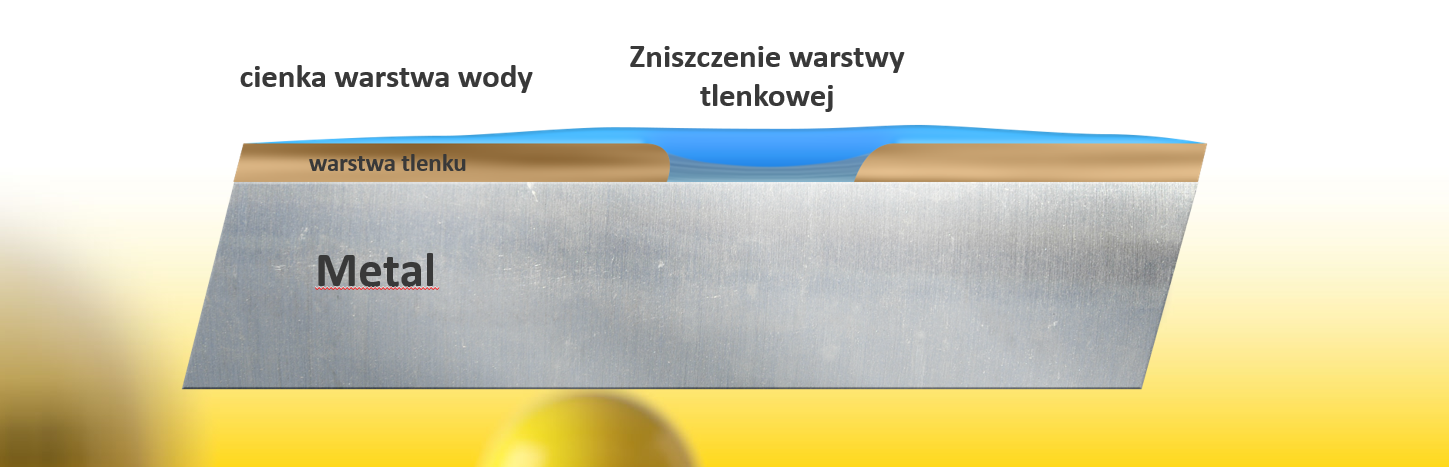
Uszkodzenie pasywnej warstwy tlenków rozpoczyna przepływ prądu pomiędzy katodą i anodą. Rozpoczyna się reakcja elektrochemiczna = korozja
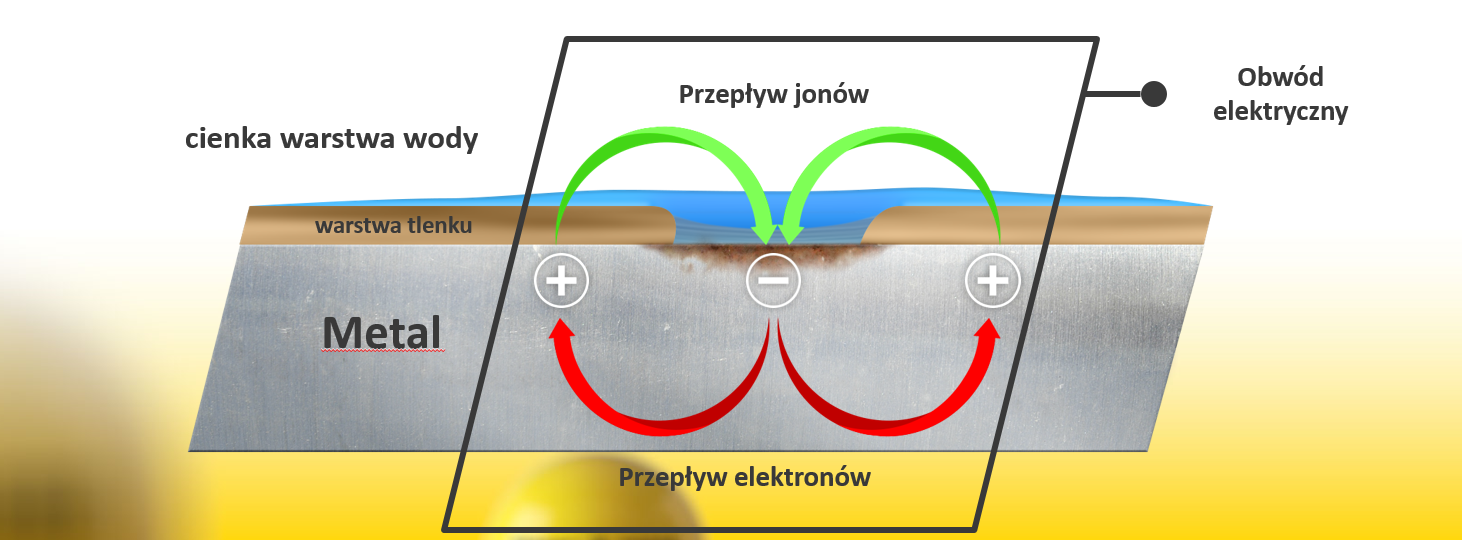
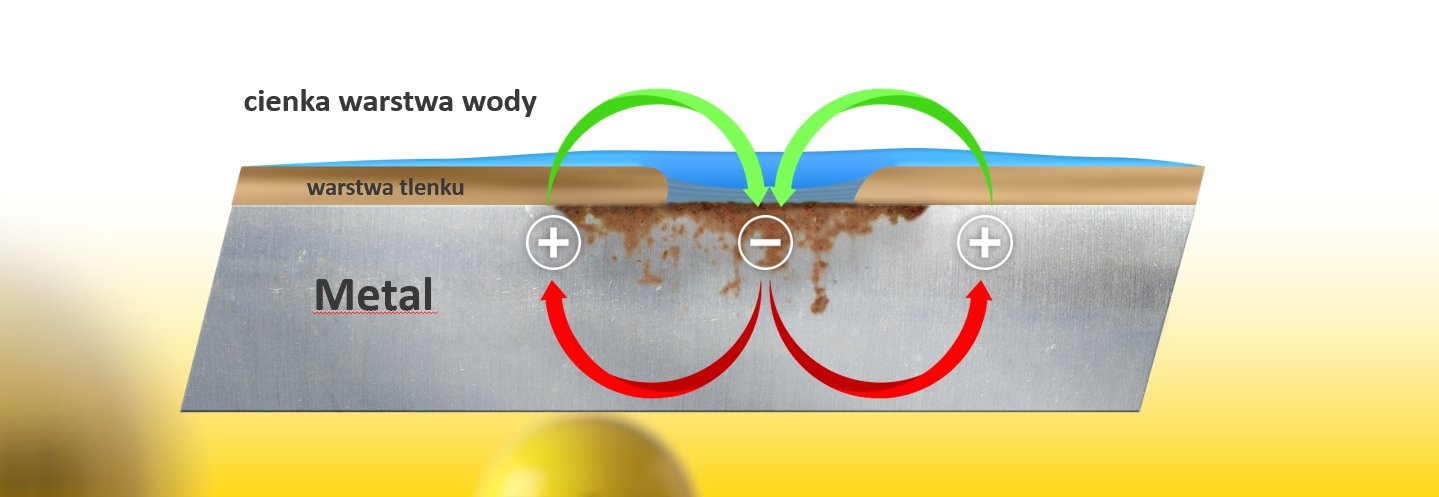
Korozja będzie się rozwijać się do momentu, aż obwód elektryczny nie zostanie przerwany.
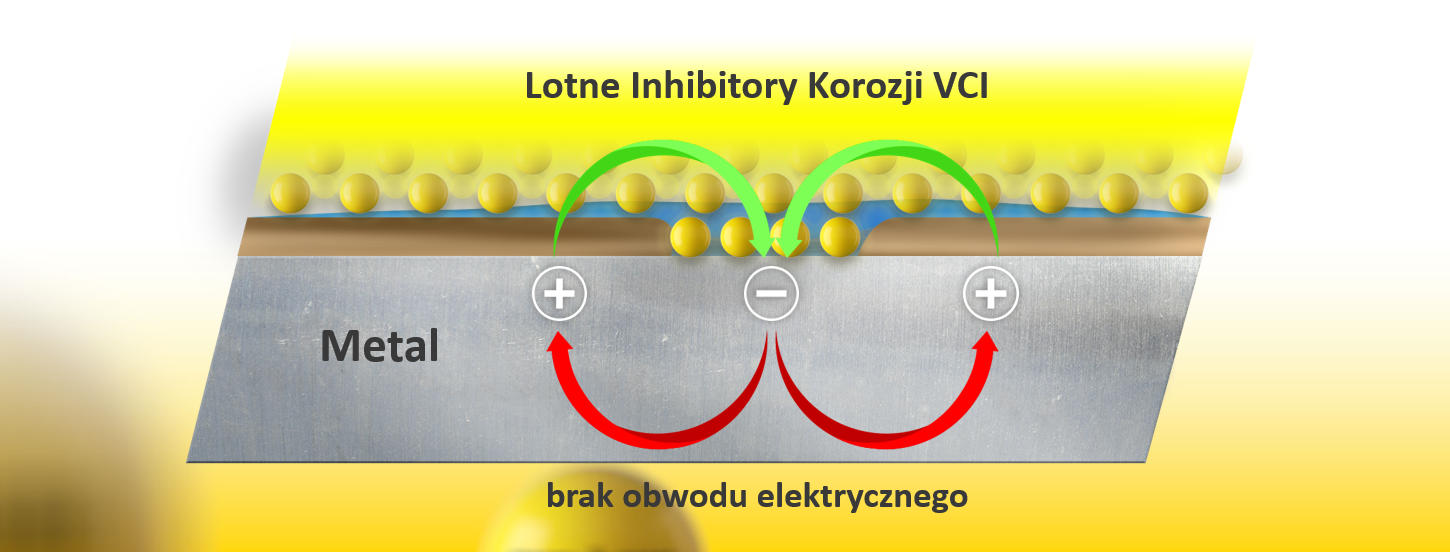
Jak działają lotne inhibitory korozji VCI?
Rozwiązaniem problemu rdzewienia metali może być zastosowanie inhibitorów korozji. Rozróżniamy występuję ich kilka rodzajów, np:
- Tradycyjne inhibitory kontaktowe – znajdują zastosowanie zarówno do ochrony metali żelaznych jak i nieżelaznych;
- Lotne inhibitory korozji;
- Inne rodzaje inhibitorów jak np. inhibitory absorpcyjne.
Przyjrzyjmy się bliżej związkom zwanym ogólnie VCI. Proces ulatniania się lotnych inhibitorów korozji działa trzyetapowo:
- Dochodzi do sublimacji cząsteczek VCI z nośnika (folia lub papier)
- Inhibitory korozji samoistnie rozprzestrzeniają się we wnętrzu opakowania (dyfuzja cząsteczkowa)
- Inhibitory korozji pokrywają w całości powierzchnię stali.
Następnie, warstwa inhibitorów korozji na powierzchni przerywa obwód elektryczny, a więc hamuje reakcję elektrochemiczną.
Czynniki środowiskowe przyspieszające procesy korozyjne
Korozja jest procesem nieuchronnego niszczenia metali żelaznych i przebiega w sposób nieprzerwany. Nawet jeśli żelazo (lub inny metal) jest czyste, i tak na powierzchni metalu tworzą się lokalne ogniwa, w których zachodzi korozja. Wszystkie dostępne technologie antykorozyjne, w tym inhibitor korozji są w stanie jedynie zredukować tempo przebiegu procesu, natomiast nigdy nie są w stanie go całkowicie zahamować.
Dodatkowo, istnieje szereg innych czynników środowiskowych, które przyspieszają proces korozji. Lokalne różnice stężeń tlenu, temperatury i pH na powierzchni metalu również przyczyniają się do akceleracji tego procesu.
Chlorki
Największe uszkodzenia metali żelaznych powodują występujące w przyrodzie jony chloru Cl–. Pod wpływem ekspozycji na wilgoć i tlen, hydrolizują z wytworzeniem tlenku żelazowego lub wodorotlenku żelazowego i kwasu solnego. Kwas solny z kolei utlenia pozostały nieskorodowany metal do chlorku żelaza i wodoru lub chlorku żelaza i wody. Ta reakcja nigdy się nie kończy i będzie kontynuowana, dopóki metal nie ulegnie korozji w 100%.
Reakcja chemiczna przebiega w sposób następujący:
Fe – 2e–>> Fe+2
Fe+2+ 2Cl– >> FeCl2
4FeCl2+ 4H2O + O2>> 2Fe2O3+ 8HCl
4FeCl2+7H2O + O2>> 2Fe2O3·3H2O + 8HCl
2FeCl3+ 3H2O >> Fe2O3+ 6HCl
4FeCl3+ 9H2O >> 2Fe2O3·3H2O + 12HCl
Fe0+ 2HCl >> FeCl2+ H2
4Fe0+ 3O2+ 12HCl >> 4FeCl3+ 6H2O
Dwutlenek siarki
Kolejnym agresywnym czynnikiem środowiskowym przyspieszającym korozję jest dwutlenek siarki. Wytwarza się on w procesie spalania paliw kopalnych, jest gazem silnie trującym i szkodliwym, przyczynia się do zanieczyszczenia atmosfery i tworzenia się smogu. Z drugiej strony wykorzystuje się go w przemyśle spożywczym jako konserwant (E220) i w procesie produkcji wina.
Ze względu na dobrą rozpuszczalność w wodzie, może rozpuszczać się w cienkiej warstwie wilgoci, która formuje się na powierzchniach metalowych, gdy wilgotność względna przekroczy 40%. Powstały w ten sposób kwaśny elektrolit może stymulować reakcje anodowo – katodowe i przyczyniać się do powstawania rdzy.
Zastosowanie inhibitorów korozji w przemyśle
Zwyczajowo metody ochrony przed korozją polegają na tworzeniu chemicznych powłok ochronnych lub lakierniczych. Przedstawiony w powyższym artykule mechanizm może być z powodzeniem wykorzystany w kilku dziedzinach przemysłu, jako zastępstwo lub uzupełnienie standardowych form ochrony. Wyróżniamy kilka zastosowań inhibitorów korozji:
- Opakowania antykorozyjne VCI wykorzystywane są do zabezpieczania elementów metalowych w transporcie morskim. Z takich rozwiązań korzystają producenci z branż motoryzacyjnej, metalowej lotniczej, obróbczej, hutniczej czy stoczniowej.
- Kontaktowe inhibitory dodaje się do wielu preparatów olejowych i smarowych, w celu poprawienia ich właściwości antykorozyjnych.
- W wielu procesach przemysłowych wykorzystywana jest zwykła woda, na przykład przy wykonywaniu prób szczelności lub jako medium w instalacjach przeciwpożarowych. Do ochrony takich systemów wykorzystuje się dodatki inhibitorów. Neutralizują one jony zawarte w wodzie i sprawiają, że staje się ona niereaktywna.
- Inhibitory antykorozyjne mogą być wdmuchiwane w postaci proszku do wszelkich przestrzeni zamkniętych, lub umieszczane w specjalnych kapsułkach zwanych emiterami. Takie rozwiązanie antykorozyjne można wykorzystać przy ochronie na przykład elektryki i elektroniki w szafach sterowniczych,
- Przemysł offshore charakteryzuje się wieloma obszarami wymagającymi ochrony antykorozyjnej. Inhibitory wykorzystuje się do ochrony przed korozją na przykład dna zbiorników na paliwo, do ochrony rurociągów, połączeń spawanych, kryz i zaworów. Zabezpieczenie tego typu instalacji przed korozją jest konieczne dla utrzymania bezpieczeństwa i bezawaryjności instalacji.
Jakie są korzyści z zastosowania lotnych inhibitorów VCI?
- Chronią przed korozją w trudno dostępnych miejscach, gdzie żadna inna metoda nie mogłaby być zastosowana.
- Działają kompleksowo na podstawy procesy zachodzące w środowisku – nie ważne, czy korozję wywołują warunki atmosferyczne czy chemiczne.
- Rozwiązania antykorozyjne VCI chronią przed korozją na tyle skutecznie, że nie wymagają użycia innych materiałów i preparatów chemicznych. Okres ochrony może wynosić nawet do 15 lat.
- opakowania antykorozyjne nie pozostawiają żadnych śladów na powierzchni elementów chronionych – ochrona jest czysta i nie wymaga rozkonserwowania ani mycia.
- VCI to też skuteczny sposób na zabezpieczenie antykorozyjne urządzeń i elementów na czas przestoju lub długotrwałego składowania. Sprzęt wojskowy na czas pokoju chroniony jest tą metodą.
